ახალგაზრდა პაროდონტოლოგის წვლილი - February 21, 2020
მინანქრის მატრიქსის წარმოებული (Enamel Matrix Derivative - EMD) ხშირად გამოყენებული ბიოლოგიური ნივთიერებაა, რომელსაც შეუძლია ხელი შეუწყოს პაროდონტული ჭრილობის შეხორცებასა და რეგენერაციას. EMD-ს აქვს ანთების საწინააღმდეგო და ანგიოგენეზური თვისებები, ხელს უწყობს ფიბრობლასტების პროლიფერაციასა და ოსტეობლასტების დიფერენციაციას. უახლესი კვლევების თანახმად, პაროდონტიტის არაქირურგიული მკურნალობისა და EMD-ის ერთდროული გამოყენება არაქირურგიულ მკურნალობასთან შედარებით მნიშვნელოვნად აუმჯობესებს პაროდონტის ქსოვილების კლინიკურ პარამეტრებს და ამცირებს სისტემური ანთების დონეს.
დისერტაციის სათაური: „არაქირურგიული პაროდონტული მკურნალობის შემდეგ სისტემური ანთების მარკერებზე მინანქრის მატრიქსის წარმოებულის გავლენა: რანდომიზებული კლინიკური კვლევა“
დისერტაციის ავტორი: ლაურა ბეტტინი
უნივერსიტეტი:: პიზის უნივერსიტეტი, იტალია
ხელმძღვანელი:: პროფესორი F. Graziani ფ.გრაციანი
EGR (EMD-ს გამოყენებით მართული რეგენერაცია)
მინანქრის მატრიქსის წარმოებული (Enamel Matrix Derivative - EMD) არის ღორის კბილის ჩანასახის არაუჯრედული მატრიქსიდან წარმოებული ნივთიერება, რომელიც უმეტესად შედგება წყალში გახსნილი ამელოგენინებისაგან, რომლებიც, უწყობენ ხელს პაროდონტის ქსოვილების რეგენერაციას.
კბილის განვითარების დროს, ფესვის ჰერტვიგის ეპითელური გარსი წარმოქმნის მომწიფებული ამელობლასტების მიერ სეკრეტირებული მინანქრის მატრიქსის მსგავს უჯრედშორის ნივთიერებას (მატრიქსს). ასევე უუჯრედო დუღაბიც შეიცავს მინანქრის მატრიქსული პროტეინების (Enamel matrix proteins - EMPs) მსგავს ცილებს. პაროდონტის ქსოვილების რეგენერაციაში EMD-ს გამოყენება ეფუძნება ფესვის მორფოგენეზის დროს EMPs-ს მონაწილეობას უუჯრედო დუღაბისა და კბილის ირგვლივი ქსოვილების ჩამოყალიბებაში. ამ პროტეინების (რომლებიც მინანქრის ძირითად ნაწილს ქმნიან) 90%-ს შეადგენს ამელოგენინები და დარჩენილ 10%-ს ტუფტელინები და სხვა ტიპის ცილები. არსებობდა ჰიპოთეზა, რომ პაროდონტიტით დაზიანებულ კბილზე EMD-ს ქირურგიული გამოყენება ხელს შეუწყობდა ბუნებრივი უჯრედშორისი მატრიქსის ჩამოყალიბებას, რომელიც, თავის მხრივ, ხელს რეგენერაციული პროცესების პროვოცირებას მოახდენდა. ფაქტობრივად, in vitro კვლევებმა აჩვენა თუ რა როლი აქვს EMD-ს უჯრედების მიმაგრებაში, მიტოგენეზში, ბიოსინთეზსა და დიფერენცირებაში. ამასთანავე, სხვადასხვა უჯრედი სხვადასხვაგვარად რეაგირებს EMD-ს მოქმედებაზე: მაგალითად, მას შეუძლია გააუმჯობესოს პერიოდონტული იოგის ფიბრობლასტების მიმაგრება, თუმცა, გავლენას არ ახდენს ღრძილის ფიბრობლასტებსა და ეპითელურ უჯრედებზე, რაც მიუთითებს EMD-ს შერჩევით მოქმედებაზე, რაც თავის მხრივ, ხელსაყრელია ჭრილობის შეხორცების ადრეულ ეტაპებზე. გარდა ამისა, პერიოდონტული იოგის უჯრედთა კულტურაში EMD იწვევს ანთების მედიატორებისა და ხსნადი ფაქტორების (მათ შორის TGF-β1 და IL-6) აუტოკრინულ გამოთავისუფლებას (Lyngstadaas et. Al. 2001). ამასთანავე, EMD-ს შეუძლია უშუალოდ იმოქმედოს ღრძილზედა ნადების წამოაქმნაზე, რადგან ხელს უშლის პაროდონტოპათოგენური ბაქტერიების ზრდას (Arweiler, Auschill, Donos & Sculean 2002). საბოლოოდ, EMD-ით მკურნალობა ზრდის გრანულაციური ქსოვილის რაოდენობას და აჩქარებს ეპითელიზაციის პროცესს, შედეგად ჭრილობის შეხორცება ხდება სწრაფად, რაც შესაძლოა განპირობებული იყოს ანგიოგენეზური ეფექტითა და ზრდის ფაქტორებისა და პროტეინაზების გაზრდილი რაოდენობით. საბოლოო ჯამში, ნაჩვენებია, რომ EMD-ს ახასიათებს ანთების საწინააღმდეგო მოქმედება და შეუძლია ხელი შეუწყოს როგორც, ფესვის ზედაპირზე ფიბრობლასტების პროლიფერაციას, ისე ოსტეობლასტების დიფერენციაციას; ამგვარად, პაროდონტული მკურნალობის დროს ფესვის ზედაპირზე მისი აპლიკაცია (მოთავსება) ხელს უწყობს პაროდონტის ქსოვილების რეგენერაციას. თავდაპირველად ხდება სქეილინგი (კბილის ნადების მოშორება, გაწმენდა) და ფესვის ზედაპირის გასადავება, ხოლო შემდეგ მჟავური გრავირება, რის შედეგადაც ფესვის ზედაპირიდან შორდება პოხიერი ნივთიერება და საშუალებას იძლევა ორგანული ნარჩენების გარეშე ფესვის ზედაპირზე EMD-ს მიმაგრებას.
EMD-ის კლინიკური და რენტგენოლოგიური ეფექტურობა კლინიკური მიმაგრების აღდგენასა და ძვლის რეგენერაციაში პირველად სკანდინავიურ ქვეყნებში ჩატარებული ორი მულტიცენტრული კვლევის საფუძველზე დადასტურდა (Heijl, Heden Svardstrom & Ostgren 1997, Zetterstrom et. Al. 1997). შემდეგ ბევრი მკვლევარის და კლინიცისტის კლინიკურმა შემთხვევებმა დაადასტურა პირველადი შედეგები, რომ ძვალშიდა დეფექტებში (ძვლის ვერტიკალურ დეფექტებში) EMD-ს აპლიკაცია მნიშვნელოვნად აუმჯობესებს კლინიკურ მიმაგრებას (Clinical attachment), ამცირებს ზონდირების სიღრმეს (Probing depth) და ზრდის ძვლის რეგენერაციას. შემდეგი ეტაპი იყო EMD-ს გამოყენებით მართული რეგენერაციის (EGR) შედარება სხვა რეგენერაციული და თერაპიული მეთოდების გამოყენებასთან და ასევე სხვა ტექნიკების კომბინაციასთან. უამრავმა კვლევამ დაადასტურა EMD-ს გამოყენებით მართული რეგენერაციის კლინიკური უპირატესობა ღია ნაფლეთოვან ოპერაციასთან შედარებით (Open Flap Debridement - OFD); კლინიკური შედეგები იყო მსგავსი იმ კვლევებშიც, სადაც მოხდა EMD-ის შედარება სხვადასხვა რეზორბირებადი ან არარეზორბირებადი მემბრანების გამოყენებასთან.
თანხებისა და თერაპიული შედეგების მსგავსების გათვალისწინებით, მიზანშეწონილია ერთმანეთს შევადაროთ EGR და GTR. ცნობილია, რომ მემბრანის წარმატებული აპლიკაცია მნიშველოვანწილად დამოკიდებულია გამოყენებულ ქირურგიულ ტექნიკაზე და საჭიროებს მემბრანის ღრძილით სრულ დაფარვას. ამასთანავე, მემბრანის ფორმის მიცემა და ფესვის ზედაპირზე ადაპტაცია მოითხოვს გარკვეულ დროს, განსაკუთრებით საღეჭი კბილების არეში და ბოლოს, საჭიროებს ისეთ ნაკერს, რომელიც მემბრანას უძრავად დააფიქსირებს სასურველ ადგილას, ხოლო არარეზორბირებადი ნაკერის გამოყენების შემთხვევაში, საჭიროებს განმეორებით ქირურგიულ ჩარევას მისი ამოღების მიზნით. ამის საპირისპიროდ, EMD-ის აპლიკაცია ბევრად იოლი და სწრაფია. EMD-ის შემცველი შპრიცით შესაძლებელია ერთ ვიზიტში ერთი და იმავე პაციენტის ბევრი დეფექტის მკურნალობა, რაც მნიშვნელოვნად ზოგავს დროსა და გაწეულ ხარჯს როგორც პაციენტის, ისე ქირურგის შემთხვევაში.
სისტემური და კლინიკური უპირატესობები
კლინიკური კვლევა, რომელსაც ეფუძნება მოცემული დისერტაცია, არის პირველი, რომელიც ერთმანეთს ადარებს EMD-ს ან მის გარეშე ჩატარებული არაქირურგიული პაროდონტოლოგიური მკურნალობის შემდეგ კლინიკური პარამეტრებისა და მწვავე ფაზის პასუხს (სისხლში ანთებითი მედიატორების გამოყოფის რაოდენობას).
„მიმდინარე კვლევის მონაცემები აჩვენებს, რომ EMD-ს ან მის გარეშე ჩატარებული არაქირურგიული პაროდონტოლოგიური მკურნალობა მნიშვნელოვნად აუმჯობესებს პაროდონტის კლინიკურ პარამეტრებს 3 თვეში და მნიშვნელოვნად ცვლის სისტემურ ანთებას.“
ზოგიერთი კვლევის თანახმად EMD-ს შეუძლია ხელი შეუწყოს პაროდონტის ქსოვილების რეგნერაციას, თუმცა, ზოგიერთ შემთხვევაში EMD-ს პოტენციალი შეზღუდულია არაშემკავებელი ვერტიკალური ძვლოვანი დეფექტების არსებობის დროს, რადგან ის ვერ უზრუნველყოფს რბილი ქსოვილების ქვეშ ძვლის რეგენერაციისთვის საჭირო სივრცის შენარჩუნებას, რაც წარმოადგენს პროგნოზირებადი რეგენერაციის მთავარ ფაქტორს. ბოლო წლებში, უფრო ხშირად გამოიყენება პაროდონტის დაავადებების არაქირურგიული მკურნალობა, რაც განპირობებულია დაბალი ფასითა და იმით, რომ პროცედურის წარმართვა შეუძლია არა მხოლოდ პაროდონტოლოგს. EMD შესაძლებელია გამოყენებულ იქნას, როგორც არაქირურგიული პაროდონტული მკურნალობის დამატებითი მეთოდი, რომელიც ამცირებს ნადების წარმოქმნას და ხელს უშლის პაროდონტოპათოგენური ბაქტერიების ზრდას. 2009 წელს გამოქვეყნებულ კვლევაში (Mellong et al. 2009) ნაჩვენებია, რომ 4-დან 3 პაციენტს, რომელთაც ჩაუტარდათ არაქირურგიული პაროდონტოლოგიური მკურნალობა EMD-ს აპლიკაციასთან ერთად, აღენიშნებოდათ პაროდონტის ქსოვილების რეგენერაცია ახალი დუღაბის, ძვლის, პაროდონტული იოგისა და შემაერთებელი ქსოვილის მიმაგრების ჩამოყალიბებით. ღრმა ძვალშიდა დეფექტების რეგენერაციის მიზნით არაქირურგიულ პაროდონტოლოგიურ მკურნალობასთან ერთად EMD-ს გამოყენების ეფექტურობა ნაჩვენები იყო რანდომიზებულ კლინიკურ კვლევაშიც (Aimetti et. Al. 2007).
კვლევა, რომელსაც ეფუძნება მოცემული დისერტაცია, გვიჩვენებს განხორციელებული მკურნალობის ეფექტურობას და შესაძლებლობას გვაძლევს აღვნიშნოთ ერთ ვიზიტად ჩატარებულ ულტრაბგერით ინსტრუმენტირებასთან ერთად EMD-ს გამოყენების უპირატესობა, რადგან მხოლოდ საკვლევ ჯგუფში დაფიქსირდა მკურალობიდან 3 თვეში პაროდონტული ჯიბის სიღრმის (>6 მმ) სტატისტიკურად მნიშვნელოვანი შემცირება.
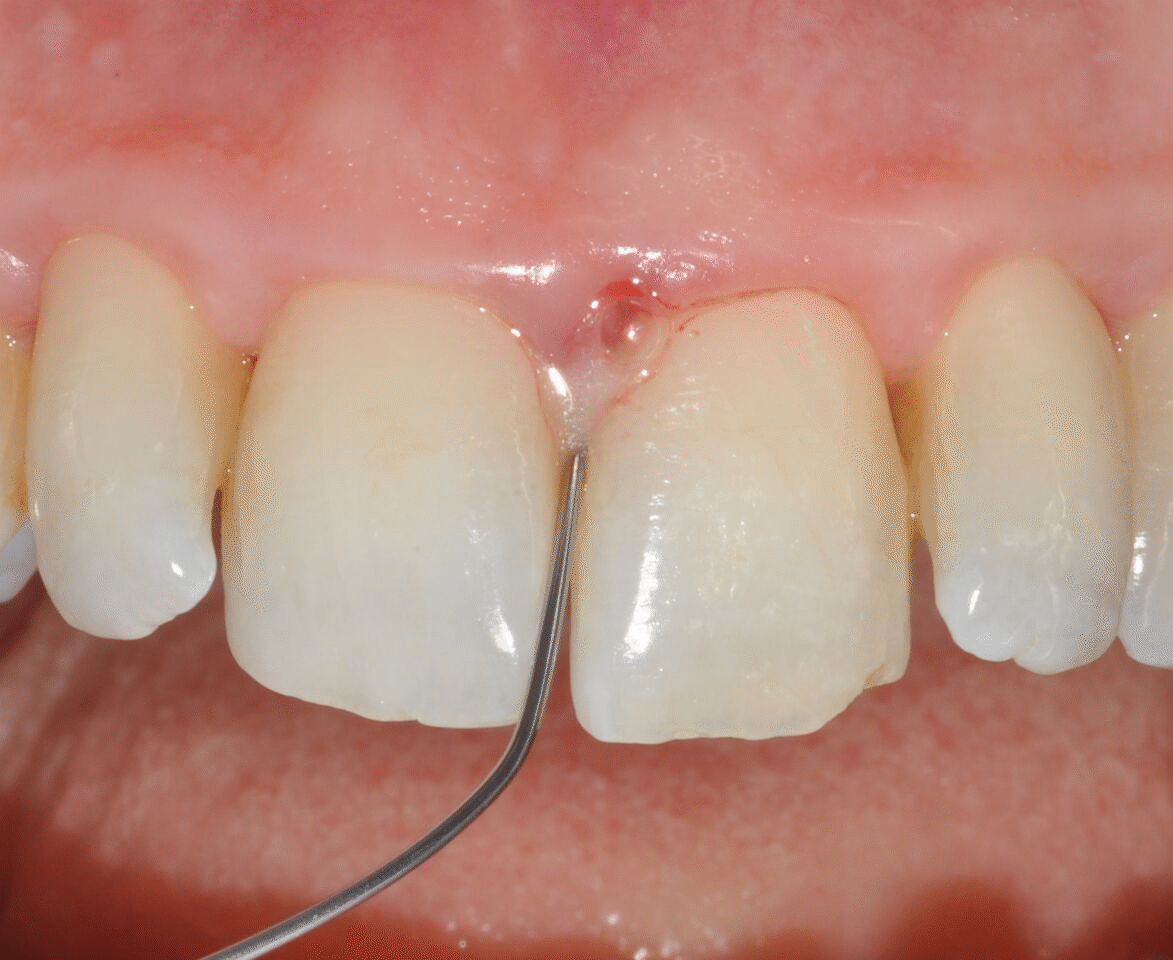
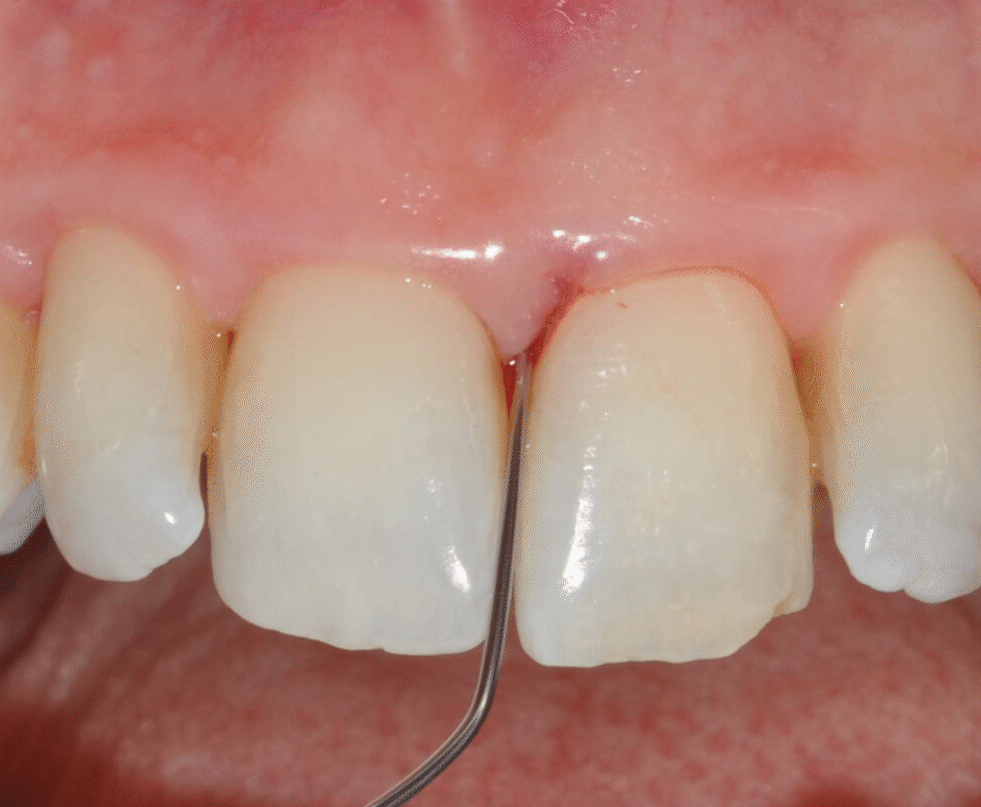
ზედა მარჯვენა ცენტრალური საჭრელის მედიალურ ზედაპირზე EDTA-ს და მინანქრის მატრიქსული წარმოებულის გელის აპლიკაცია
ანთების სისტემური მარკერების რაოდენობის პიკი ორივე - საკვლევ და საკონტროლო ჯგუფში დაფიქსირდა. მკურნალობიდან 24 საათის შემდეგ მნიშნველოვნად იყო მომატებული PCR (what does this mean? Should it be CRP). საკვლევ ჯგუფში 24 საათის შემდეგ ასევე გამოვლინდა ფიბრინოგენის მომატება, მაშინ როცა საკონტროლო ჯგუფში მკურნალობიდან 24 საათის შემდეგ ყოველთვის მომატებული იყო D-დიმერი და ცისტეინ C. ეს მონაცემები კვლავ უბრუნდებოდა საწყის მონაცემებს, თუმცა, გარკვეულწილად შემცირებული სახით. მოცემული კვლევის შედეგები თანხვედრაშია ჩატარებულ კლინიკურ კვლევებთან, რომლებიც შეისწავლიდნენ არაქირურგიული პაროდონტოლოგიური მკურნალობის გავლენას სისტემური ანთების დონეზე (D’Aiuto et. Al 2013, Graziani et. Al. 2015), სადაც მუდამ ფიქსირდებოდა მწვავე ანთებითი ფაზის საშუალო სიმძიმის პასუხი, რომელსაც თან ახლდა ღვიძლის ანთებითი ცილების, როგორიცა CRP (C რეაქტიული ცილა) რაოდენობის ზრდა. ორგანიზმის ამგვარი პასუხის მიზეზი შესაძლებელია ავხსნათ ბაქტერიემიითა და იმ იმუნური პასუხით, რომელიც მოყვება ღრძილის ინსტრუმენტირების დროს ადგილობრივად ქსოვილების დაზიანებას, რასაც შეუძლია ხელი შეუწყოს პროანთებითი მარკერების რაოდენობის მატებას და ანთებითი ფაზის ცილების პროდუქციას. ორგანიზმის სისტემური პასუხის შესახებ ინფორმაცია, რომლებიც უკავშირდება EMD-ით ნამკურნალებ ჯგუფს, თანხვედრაშია Miron et al.-ის მიერ 2016 წელს გამოქვეყნებულ მიმოხილვასთან, რომელიც აჩვენებს ამ ნივთიერების გავლენას ანთებით პასუხზე.
C რეაქტიული ცილის გაზრდილი რაოდენობა მკურნალობიდან 24 საათის შემდეგ გასაკვირი არც არის, რადგან დროებითი ანთება წარმოადგენს ღრძილისა და პაროდონტის ქსოვილების შეხორცების ფუნდამენტურ ფაქტორს, რაც უზრუნველყოფს იმ უჯრედების მოზიდვას, დიფერენცირებასა და მობილიზაციას, რომლებიც აუცილებელია რეგენერაციისთვის. საინტერესოა D-დიმერის კონცენტრაციაზე დაკვირვებაც, რომელიც წარმოადგენს ფიბრინოგენის დაშლის ერთ-ერთ პროდუქტს; მისი კონცენტრაცია მომატებულია ქრონიკული დაავადებების მქონე პაციენტებში და მცირდება პაროდონტოლოგიური მკურნალობის შემდეგ: D-დიმერის 24 საათიანი მონიტორინგი ცხადყოფს, რომ საკონტროლო ჯგუფში აღინიშნება სისტემური ანთების მკვეთრი მატება, როგორც ჯგუფშიდა (საწყისი და 24 საათის შემდეგი მონაცემების შედარებით) ისე, ჯგუფთაშორისი (საკონტროლო ჯგუფთან შედარებით) შედარების დროს.
მსგავსი, თუმცა საპირისპირო ტენდენცია შეინიშნება ფიბრინოგენთან დაკავშირებით: საკვლევ ჯგუფში სტატისტიკურად მნიშვნელოვანი პიკი აღინიშნებოდა მკურნალობიდან 24 საათის შემდეგ და მკვეთრი შემცირება 3 თვის შემდეგ, კლინიკური პარამეტრების გაუმჯობესებასთან ერთად. ნაჩვენებია, რომ ეს პოლიმერი (ფიბრინოგენი) ფიბრინის კოლტის დაშლის შედეგად გამოთავისუფლდება, რაც წარმოადგენს რეგენერაციული პროცესის საფუძველს. სისხლის შედედების დროს, ფიბრინოგენი თრომბინის დახმარებით გარდაიქმნება ფიბრინად, ხოლო შემდგომ ამ ნაერთის დაშლა ხდება, რაც იწვევს დაშლის პროქდუტების მატებას სისხლში, მათ შორის D-დიმერისაც.
თუ გავითვალისწინებთ რომ საკვლევ ჯგუფში 24 საათის შემდეგ გამოვლინდა ფიბრინოგენის სტატისტიკურად მნიშვნელოვანი პიკი, თუმცა ამავდროულად ვლინდება, რომ მისი დაშლის ერთ-ერთი პროდუქტის - D-დიმერის რაოდენობა რჩება სტაბილური, შესაძლებელია ვივარაუდოთ, რომ EMD-ს არსებობა აყოვნებს ფიბრინის დაშლას, საკონტროლო ჯგუფთან შედარებით.
ინოვაცია
კვლევის შედეგები გვიჩვენებს, თუ როგორ ამცირებს ანთების მწვავე ფაზის პასუხს პირის ღრუს სრული ულტრაბგერითი წმენდის დროს EMD-ს დამატებით გამოყენება. ამასთანავე, ულტრაბგერითი წმენდისა და EMD-ის კომბინაცია ბევრად ეფექტურად ამცირებს ზონდირების სიღრმეს მკურნალობიდან 3 თვეში, რითაც დამატებითი მკურნალობის საჭიროებაც მცირდება 50%-ით. ეს შესაძლებელია განპირობებული იყო მინანქრის მატრიქსული წარმოებულის ანთების საწინააღმდეგო მოქმედებით.
EMD-ს გამოყენება შესაძლოა იყოს განხილული არაქირურგიული პაროდონტოლოგიური მკურნალობის დროს ისეთ პაციენტებში, რომელთაც აქვთ რთული სამედიცინო ანამნეზი და/ან ისეთ სისტემური ქრონიკური დაავადებები, რომლებიც საჭიროებენ სისტემური ანთების კონტროლს; ამასთანავე, შესაძლოა იყოს რეკომენდებული EMD-სა და ულტრაბგერითი ინსტრუმენტირების კომბინირებული გამოყენება მძიმე დაზიანების მქონე პაროდონტულ უბნებში.
გამოყენებული და რეკომენდებული ლიტერატურა:
Lyngstadaas, S. P., Lundberg, E., Ekdahl, H., Andersson, C., & Gestrelius, S. (2001). Autocrine growth factors in human periodontal ligament cells cultured on enamel matrix derivative. Journal of Clinical Periodontology, 28(2), 181–8. https://www.ncbi.nlm.nih.gov/pubmed/11168744
Arweiler, N. B., Auschill, T. M., Donos, N., & Sculean, A. (2002). Antibacterial effect of an enamel matrix protein derivative on in vivo dental biofilm vitality. Clinical Oral Investigations, 6(4), 205–9. https://www.ncbi.nlm.nih.gov/pubmed/12483234
Heijl, L., Heden, G., Svärdström, G., & Ostgren, A. (1997). Enamel matrix derivative (EMDOGAIN) in the treatment of intrabony periodontal defects. Journal of Clinical Periodontology, 24(9 Pt 2), 705–14. https://www.ncbi.nlm.nih.gov/pubmed/9310876
Zetterström, O., Andersson, C., Eriksson, L., Fredriksson, A., Friskopp, J., Heden, G., … Gestrelius, S. (1997). Clinical safety of enamel matrix derivative (EMDOGAIN) in the treatment of periodontal defects. Journal of Clinical Periodontology, 24(9 Pt 2), 697–704. https://www.ncbi.nlm.nih.gov/pubmed/9310875
Mellonig, J.T., Valderrama, P., Gregory, H.J., Cochran, D.,L. (2009). Clinical and histologic evaluation of non-surgical periodontal therapy with enamel matrix derivative: a report of four cases. Journal of Periodontology, Sep;80(9):1534-40. https://www.ncbi.nlm.nih.gov/pubmed/19722806
Aimetti, M., Ferrarotti, F., Mariani, G.M., Romano, F. (2017) A novel flapless approach versus minimally invasive surgery in periodontal regeneration with enamel matrix derivative proteins: a 24-month randomized controlled clinical trial. Clinical Oral Investigations, 2017 Jan;21(1):327-337. https://www.ncbi.nlm.nih.gov/pubmed/27044318
D’Aiuto, F., Orlandi, M., & Gunsolley, J. C. (2013). Evidence that periodontal treatment improves biomarkers and CVD outcomes. Journal of Clinical Periodontology, 40, S85–S105. https://www.ncbi.nlm.nih.gov/pubmed/23631587
Graziani, F., Cei, S., Orlandi, M., Gennai, S., Gabriele, M., Filice, N., … D’Aiuto, F. (2015). Acute-phase response following full-mouth versus quadrant non-surgical periodontal treatment: A randomized clinical trial. Journal of Clinical Periodontology, 42(9), 843–52. https://www.ncbi.nlm.nih.gov/pubmed/26309133
Miron, R.J., Sculean, A., Cochran, D.L., … (2016). Twenty years of enamel matrix derivative: the past, the present and the future. Journal of Clinical Periodontology, Aug;43(8):668-83. https://www.ncbi.nlm.nih.gov/pubmed/26987551
