A young Periodontist's contribution - February 21, 2020
Il derivato della matrice di smalto (EMD) è un agente biologico ampiamente utilizzato che può migliorare la guarigione e la rigenerazione della ferita parodontale. EMD mostra proprietà antinfiammatorie e angiogeniche e può promuovere sia la proliferazione dei fibroblasti che la differenziazione degli osteoblasti. Da studi recenti è emerso come la terapia parodontale non chirurgica in associazione con EMD sia in grado di produrre un aumentato miglioramento dei parametri clinici parodontali e una minore perturbazione dell'infiammazione sistemica rispetto alla sola terapia non chirurgica.
Titolo della tesi: “L'impatto dei derivati della matrice dello smalto sui markers di infiammazione sistemica dopo terapia parodontale non chirurgica: clinical trial randomizzato.”
Tesi Autore della tesi: Laura Bettini
Università: Università di Pisa, Italia
Relatore: Professor F. Graziani
EGR (rigenerazione guidata EMD)
Il derivato della matrice dello smalto (EMD) è un derivato della matrice extracellulare derivante da gemme dentarie di origine suina, composto principalmente da amelogenine immerse in una soluzione acquosa viscosa, noto per favorire la rigenerazione parodontale.
La guaina della radice epiteliale Hertwig (HERS) dei denti in via di sviluppo deposita una matrice extracellulare simile alla matrice dello smalto secreta dagli ameloblasti maturi e il cemento acellulare contiene proteine simili alle proteine della matrice dello smalto (EMP). L'introduzione dell'EMD nella rigenerazione parodontale si basava sull'apparente coinvolgimento degli EMP nella formazione del cemento acellulare e dei tessuti di supporto del dente durante la morfogenesi delle radici. Queste proteine, che costituiscono la maggior parte dello smalto, sono costituite per il 90% da amelogenine e per il restante 10% da tufteline e altri tipi di proteine. Successivamente è stato ipotizzato che l'applicazione chirurgica di EMD su denti affetti da parodontite potesse portare alla formazione di una matrice extracellulare naturale che potesse controllare i processi rigenerativi, imitando le interazioni biologiche. In effetti, studi in vitro hanno dimostrato come l'EMD abbia un ruolo nell'attacco, nella mitogenesi, nella biosintesi e nella differenziazione cellulare. Inoltre, differenti tipi di cellule hanno differenti risposte all'EMD, il quale può migliorare l'adesione dei fibroblasti del legamento parodontale, ma non ha alcun effetto sui fibroblasti gengivali e sulle cellule epiteliali, il che indica un comportamento selettivo, in realtà particolarmente vantaggioso nelle prime fasi della guarigione. Inoltre, nelle colture di cellule del legamento parodontale, l'EMD ha indotto un rilascio autocrino di mediatori dell'infiammazione e fattori solubili tra cui TGF-β1 e IL-6 (Lyngstadaas et al., 2001). Inoltre, EMD può agire direttamente sulla placca sopragengivale, inibendo la crescita di batteri parodontopatogeni (Arweiler, Auschill, Donos e Sculean, 2002). Infine, il trattamento EMD aumenta la quantità di tessuto di granulazione e accelera il processo di epitelizzazione, accelerando così anche la guarigione della ferita, probabilmente a causa degli effetti angiogenici e dell'aumento dei livelli di fattori di crescita e proteinasi. In sintesi, l'EMD ha dimostrato di avere proprietà antinfiammatorie e può promuovere sia la proliferazione dei fibroblasti sulla superficie della radice sia la differenziazione degli osteoblasti, essendo in grado di promuovere la rigenerazione parodontale quando applicato sulla superficie della radice in seguito alla terapia parodontale. Le superfici radicolari dei difetti trattati con EMD vengono prima preparate con scaling e root planing delle radici e quindi condizionate con una soluzione di mordenzante, che rimuove lo smear layer e consente a EMD di precipitare sulla superficie ormai priva di resti organici.
L'efficacia clinica e radiografica dell'EMD in termini di attacco e aumento osseo è stata dimostrata per la prima volta da due studi multicentrici condotti nei paesi scandinavi (Heijl, Heden, Svärdström e Ostgren, 1997; Zetterström et al., 1997). Successivamente, case reports di vari ricercatori e clinici hanno confermato i risultati iniziali e stabilito che l'applicazione dell'EMD nei difetti intraossei promuove in maniera significativa l’aumento di attacco clinico (CAL), la riduzione della profondità di sondaggio (PD) e la rigenerazione ossea. Il passo successivo è stato quello di confrontare direttamente la rigenerazione guidata dall’EMD con altre metodologie rigenerative convenzionali e anche con l'uso di tecniche combinate. Numerosi studi hanno verificato la superiorità clinica dell'EGR sulla tecnica di Open Flap Debridement (OFD). I risultati clinici degli studi che hanno confrontato la EGR con altre procedure rigenerative che includevano una serie di membrane riassorbibili o non riassorbibili si sono dimostrati equivalenti.
Considerando costi simili e risultati terapeutici equivalenti, sembra appropriato confrontare la EGR con la GTR. È noto che l'applicazione corretta di una membrana dipende in larga misura dalla tecnica utilizzata e richiede una copertura totale della membrana; inoltre, la modellazione e l'adattamento della membrana alla radice richiedono tempo, specialmente nei settori posteriori, ed infine è necessaria anche una sutura che trattenga la membrana, una sutura che nel caso di fili non riassorbibili deve essere rimossa in un secondo tempo chirurgico. L'applicazione EMD è molto più semplice e veloce da eseguire: con una siringa di gel contenente EMD è possibile trattare più difetti nello stesso paziente, con un notevole risparmio di tempo e di costi, sia per il paziente che per l'operatore.
Benefici sistemici e benefici clinici
La sperimentazione clinica su cui si basa la tesi è la prima che confronta, oltre ai parametri clinici, la risposta della fase acuta dopo il trattamento parodontale non chirurgico con e senza l'applicazione del derivato della matrice dello smalto.
I risultati di questo studio mostrano come la terapia parodontale non chirurgica, eseguita in maniera intensiva, con e senza l'aggiunta di EMD, sia in grado di produrre un significativo miglioramento dei parametri parodontali clinici a 3 mesi e una significativa perturbazione dell'infiammazione sistemica.
Numerosi studi hanno dimostrato la capacità dell'EMD di promuovere la rigenerazione parodontale, tuttavia in alcune situazioni questo potenziale è limitato a causa dell'incapacità del gel di EMD di supportare i tessuti molli in difetti non contenitivi, un elemento chiave per ottenere una rigenerazione prevedibile. Negli ultimi anni, la terapia parodontale non chirurgica è stata sempre più utilizzata, grazie alla riduzione dei costi e alla possibilità di essere eseguita non solo da specialisti in parodontologia. Lo stesso EMD potrebbe rappresentare uno strumento aggiuntivo alla terapia parodontale non chirurgica grazie anche alla sua capacità di ridurre la placca e la crescita di batteri parodontopatogeni. Uno studio pubblicato nel 2009 (Mellonig et al. 2009) ha mostrato che in 3 su 4 pazienti trattati con terapia non chirurgica e EMD è stata registrata la rigenerazione parodontale, con la formazione di nuovo cemento, osso e legamento parodontale. L'efficacia di EMD in aggiunta alla terapia parodontale non chirurgica nel promuovere la rigenerazione dei difetti infraossei profondi è stata dimostrata anche in uno studio clinico controllato e randomizzato (Aimetti et al. 2017).
Nello studio su cui si basa la tesi è stato riportato un successo generale della terapia, ed è stato possibile registrare un'effettiva superiorità dell'aggiunta di EMD alla strumentazione ad ultrasuoni eseguita in una singola seduta, avendo avuto una riduzione statisticamente significativa delle tasche> 6mm a 3 mesi solo nel gruppo test.
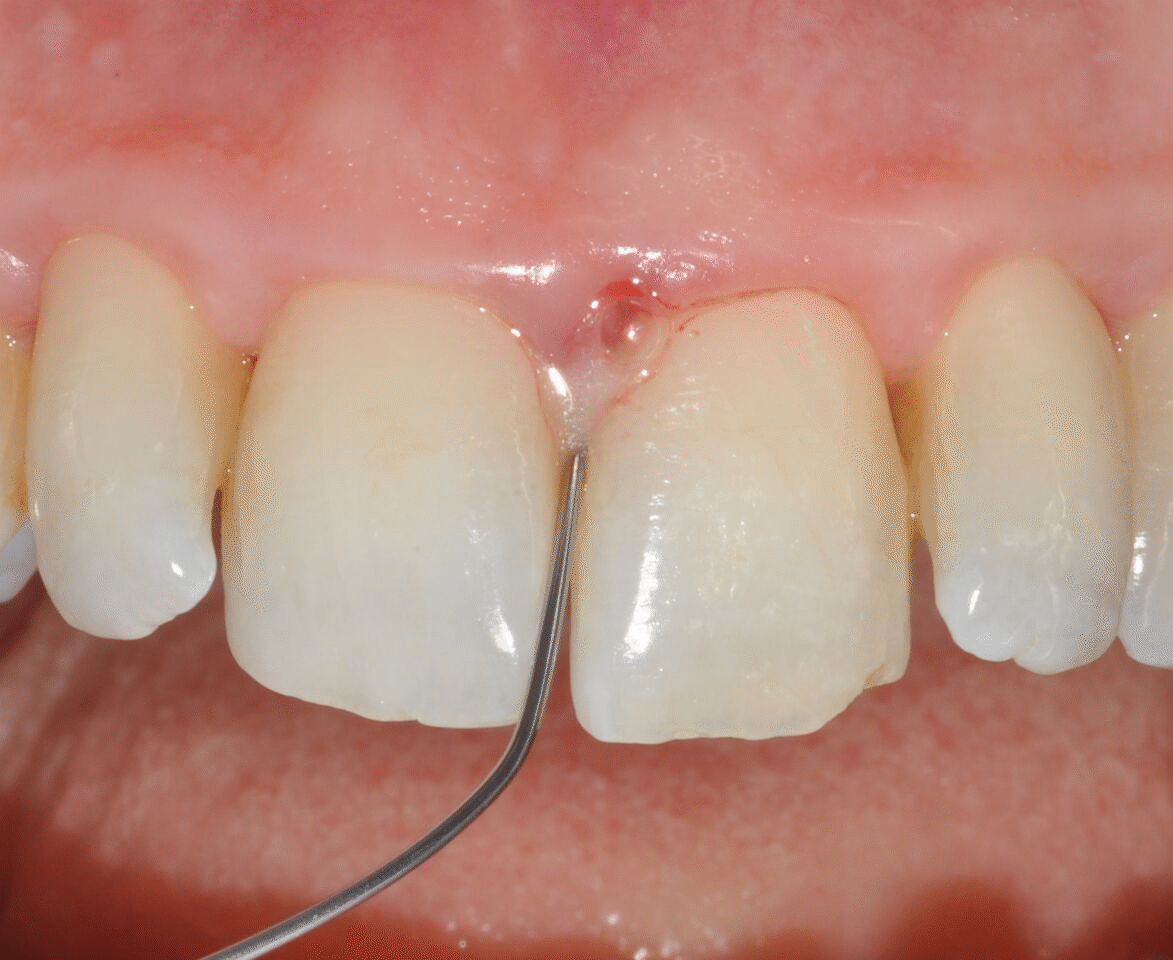
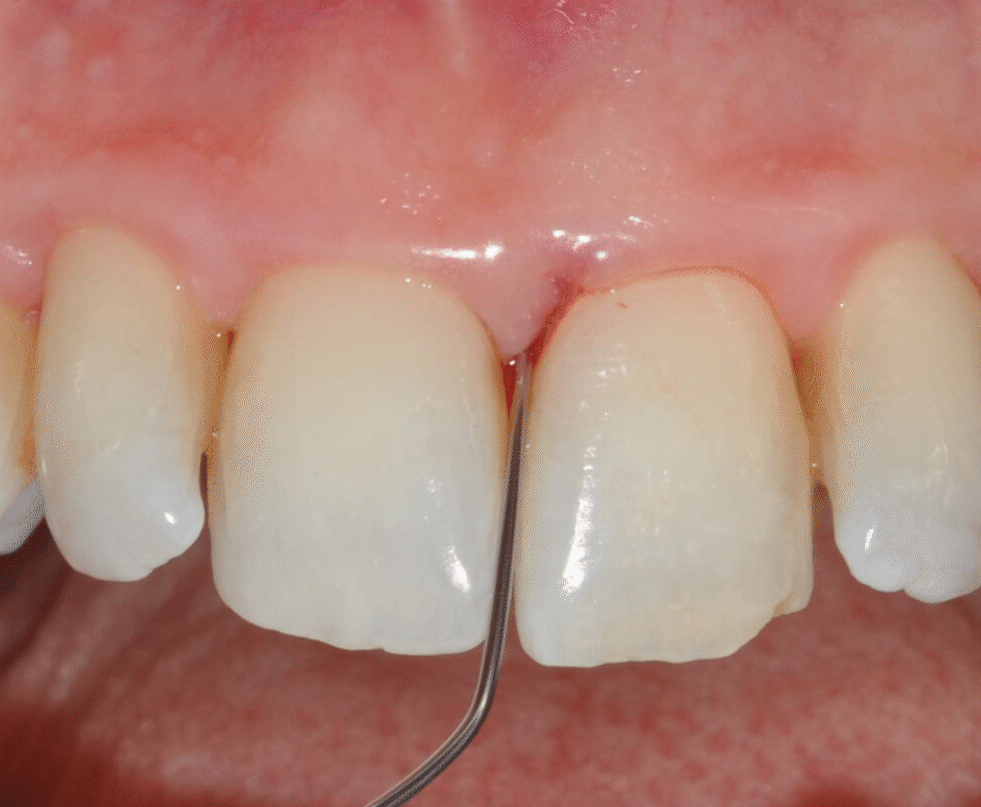
Application of EDTA and Enamel Matrix Derivative gel in the mesial pocket of an upper right central incisor
Per quanto riguarda i dati dei markers sistemici, è stato registrato un picco di infiammazione sia nel test che nel gruppo di controllo, registrato attraverso aumenti significativi della PCR a 24 ore dopo il trattamento. Nel gruppo di test è stato riscontrato anche un aumento del fibrinogeno dopo 24 ore, mentre nel gruppo di controllo è stato rilevato un aumento del D-dimero e della cistatina C sempre dopo 24 ore dal trattamento. Questi valori sono quindi tornati a valori simili al baseline, sebbene generalmente leggermente diminuiti. I dati prodotti da questo studio sono in accordo con precedenti ricerche cliniche che hanno studiato l'effetto della terapia parodontale non chirurgica sull'infiammazione sistemica (D'Aiuto et al. 2013, Graziani et al. 2015), dove più volte è stata riportata una moderata risposta di fase acuta con aumento delle proteine infiammatorie epatiche, come la CRP, in seguito alla terapia parodontale non chirurgica. La ragione di questo tipo di risposta può essere spiegata dalla batteriemia e dalla risposta immunitaria che segue il danno dei tessuti locali causato dalla strumentazione gengivale, che può portare ad un aumento dei markers pro-infiammatori e delle proteine della fase acuta. I dati sistemici relativi al gruppo trattato con EMD sono in accordo con la recensione pubblicata da Miron et al. nel 2016 (Miron et al. 2016), che ha dimostrato come questa sostanza sia in grado di influenzare la risposta infiammatoria.
I livelli più elevati di CRP a 24 ore non sorprendono, perché l'infiammazione transitoria è un fattore fondamentale per la guarigione gengivale e parodontale, consentendo il reclutamento, la differenziazione e la mobilizzazione delle cellule che sono fondamentali per la rigenerazione. È interessante osservare la concentrazione di D-dimero, uno dei prodotti della degradazione del fibrinogeno, che è particolarmente aumentato nei soggetti con malattie croniche e che generalmente diminuisce dopo il trattamento parodontale: i dati del D-dimero a 24 ore confermano che l'infiammazione sistemica del gruppo controllo è aumentata in modo significativo, sia in termini di differenze all'interno del gruppo (rispetto al baseline) sia di differenze tra gruppi (rispetto al gruppo test).
Una tendenza simile ma opposta è stata registrata con il fibrinogeno: nel gruppo test si è registrato un picco statisticamente significativo a 24 ore e una drastica riduzione a 3 mesi, in linea con il miglioramento dei parametri clinici. È stato dimostrato che questo polimero viene rilasciato durante le fasi di dissoluzione del coagulo di fibrina, fondamentale per i processi di rigenerazione. Durante la coagulazione, il fibrinogeno viene convertito in fibrina dalla trombina e quindi questo viene degradato, causando un aumento dei prodotti di degradazione, incluso il D-dimero.
Considerando che a 24 ore nel gruppo test il fibrinogeno è caratterizzato da un picco statisticamente significativo, ma uno dei suoi ultimi prodotti di degradazione, il D-dimero, sembra rimanere costante, è possibile ipotizzare che la presenza di EMD possa ritardare la degradazione del coagulo di fibrina.
Innovazione
I risultati mostrano come l'aggiunta di EMD al Fm-UD (full-mouth ultrasonic debridement) sia associata ad una minore risposta infiammatoria di fase acuta rispetto al solo Fm-UD. Inoltre, Fm-UD + EMD risulta essere più efficace nel ridurre la profondità di sondaggio a 3 mesi dalla terapia rispetto al Fm-UD, riducendo la necessità di ulteriori terapie del 50%. Ciò potrebbe essere dovuto ad alcuni possibili effetti antinfiammatori dell'EMD.
Dovrebbe essere presa in considerazione l'aggiunta di EMD al trattamento parodontale non chirurgico in pazienti con anamnesi complessa e/o comorbidità, in cui è necessario controllare lo stato infiammatorio sistemico; inoltre l'aggiunta di EMD alla strumentazione parodontale ultrasonica è consigliata nei siti più profondi.
Letterature e letture suggerite:
Lyngstadaas, S. P., Lundberg, E., Ekdahl, H., Andersson, C., & Gestrelius, S. (2001). Autocrine growth factors in human periodontal ligament cells cultured on enamel matrix derivative. Journal of Clinical Periodontology, 28(2), 181–8. https://www.ncbi.nlm.nih.gov/pubmed/11168744
Arweiler, N. B., Auschill, T. M., Donos, N., & Sculean, A. (2002). Antibacterial effect of an enamel matrix protein derivative on in vivo dental biofilm vitality. Clinical Oral Investigations, 6(4), 205–9. https://www.ncbi.nlm.nih.gov/pubmed/12483234
Heijl, L., Heden, G., Svärdström, G., & Ostgren, A. (1997). Enamel matrix derivative (EMDOGAIN) in the treatment of intrabony periodontal defects. Journal of Clinical Periodontology, 24(9 Pt 2), 705–14. https://www.ncbi.nlm.nih.gov/pubmed/9310876
Zetterström, O., Andersson, C., Eriksson, L., Fredriksson, A., Friskopp, J., Heden, G., … Gestrelius, S. (1997). Clinical safety of enamel matrix derivative (EMDOGAIN) in the treatment of periodontal defects. Journal of Clinical Periodontology, 24(9 Pt 2), 697–704. https://www.ncbi.nlm.nih.gov/pubmed/9310875
Mellonig, J.T., Valderrama, P., Gregory, H.J., Cochran, D.,L. (2009). Clinical and histologic evaluation of non-surgical periodontal therapy with enamel matrix derivative: a report of four cases. Journal of Periodontology, Sep;80(9):1534-40. https://www.ncbi.nlm.nih.gov/pubmed/19722806
Aimetti, M., Ferrarotti, F., Mariani, G.M., Romano, F. (2017) A novel flapless approach versus minimally invasive surgery in periodontal regeneration with enamel matrix derivative proteins: a 24-month randomized controlled clinical trial. Clinical Oral Investigations, 2017 Jan;21(1):327-337. https://www.ncbi.nlm.nih.gov/pubmed/27044318
D’Aiuto, F., Orlandi, M., & Gunsolley, J. C. (2013). Evidence that periodontal treatment improves biomarkers and CVD outcomes. Journal of Clinical Periodontology, 40, S85–S105. https://www.ncbi.nlm.nih.gov/pubmed/23631587
Graziani, F., Cei, S., Orlandi, M., Gennai, S., Gabriele, M., Filice, N., … D’Aiuto, F. (2015). Acute-phase response following full-mouth versus quadrant non-surgical periodontal treatment: A randomized clinical trial. Journal of Clinical Periodontology, 42(9), 843–52. https://www.ncbi.nlm.nih.gov/pubmed/26309133
Miron, R.J., Sculean, A., Cochran, D.L., … (2016). Twenty years of enamel matrix derivative: the past, the present and the future. Journal of Clinical Periodontology, Aug;43(8):668-83. https://www.ncbi.nlm.nih.gov/pubmed/26987551
