მასპინძელ ორგანიზმზე თვალის დევნება - January 13, 2022
დაავადების მამოდიფიცირებელი ანტი-რევმატული მედიკამენტები (დმარმ) წარმოადგენენ თერაპიულ აგენტებს, რომლებიც მოქმედებენ რევმატოიდული ართრიტის აქტივობაზე და ხელს უშლიან ან აფერხებენ სახსრის სტრუქტურულ დაზიანებას. პათოფიზიოლოგიური და კლინიკური მიმდინარეობის თვალსაზრისით, პაროდონტიტსა და რევმატოიდულ ართრიტს ბევრი რამ აქვთ საერთო; რევმატოიდულ ართრიტისა და პაროდონტიტის საერთო პროანთებითი და ქსოვილის დამაზიანებელი კავშირების გამო წამოიჭრა პაროდონტის ანთებაზე დმარმ-ის გავლენის საკითხი.
------
რევმატოიდული ართრიტი ქრონიკული ავტოიმუნური დაავადებაა, რომლითაც მსოფლიო მოსახლეობის 0,1-2,0% ავადობს. იგი უფრო ხშირად ვითარდება ქალებში და უპირატესად აღენიშნება ასაკოვან ადამიანებს, 65-74 წლის ასაკში. თავდაპირველად, იგი ვლინდება როგორც ქრონიკული ანთებითი ართროპათია, რასაც მოჰყვება ხრტილის დაშლა, ძვლის ეროზია და შემდგომ, სახსრის ფუნქციის დაქვეითება. რევმატოიდული ართრიტი ჰეტეროგენული დაავადებაა, რომელსაც მრავალფეროვანი კლინიკური ფენოტიპი/გამოვლინება და მიმდინარეობა აქვს. ბოლო ათწლეულების განმავლობაში გამოქვეყნებული კვლევები მოწმობენ, რომ სახსრის შეუქცევადი დაზიანება და დეფორმაციები შესაძლოა განვითარდეს დაავადების საწყის თვეებშივე. შესაბამისად, ამჟამად რეკომენდებულია ადრეული დიაგნოსტიკა და სათანადო მკურნალობა, სანამ გამოვლინდება რაიმე სახის დეფორმაცია, რათა შენელდეს დაავადების პროგრესირება და შეიცვალოს მისი მიმდინარეობა („დაავადების გადასვლა რემისიაში“).
წლების განმავლობაში, რევმატოიდული ართრიტის მკურნალობა ძირფესვიანად შეიცვალა, სიმპტომების შემსუბუქების (მაგ.: ანალგეტიკები და არასტეროიდული ანთების საწინააღმდეგო მედიკამენტები) მიდგომა შეიცვალა თერაპიული აგენტების გამოყენებით, რომლებიც მოქმედებენ დაავადების აქტივობაზე და ხელს უშლიან ან აფერხებენ სახსრის სტრუქტურულ დაზიანებას. მათ აერთიანებენ საერთო ტერმინის ქვეშ - დაავადების მამოდიფიცირებელი ანტირევმატული მედიკამენტები (დმარმ). განარჩევენ დმარმ-ის ორ მთავარ ჯგუფს, რომელთაც ეწოდება სინთეზირებული (ს-) და ბიოლოგიური (ბ-) დმარმ-ები. სინთეზირებული დმარმ-ები შესაძლოა დაიყოს ჩვეულებრივ და მიზანმიმართულად სინთეზირებულ დმარმ-ებად. ამათგან პირველი წარმოადგენს სამკურნალო აგენტების უძველეს კლასს და მოიცავს სტანდარტულ სისტემურ მედიკამენტებს, რომლებიც უფრო მეტად თრგუნავენ იმუნურ სისტემას, ვიდრე ბიოლოგიური ან მიზანმიმართულად სინთეზირებული დმარმ-ები. მათი გამოყენება ხდებოდა ემპირიულად და მოქმედების მექანიზმი არ არის სრულად ცნობილი. ოქროს მარილები წარმოადგენდნენ ჩვეულებრივად სინთეზირებული დმარმ-ების ადრეულ ფორმას, რომელიც ხელმისაწვდომი იყო 1920-იანი წლებიდან. მომდევნო წლებში, ხელმისაწვდომი გახდა ახალი ჩვეულებრივად სინთეზირებული დმარმ-ები (1940-იან წლებში სულფასალაზინი და 1950-იან წლებში ჰიდროქსიქლოროქვინი). 1980-იან წლებში დამტკიცდა, რომ მეტოტრექსატი - მედიკამენტი, რომელიც, როგორც წესი, გამოიყენება ფსორიაზის სამკურნალოდ - არის უსაფრთხო და ადვილად ასატანი რევმატოიდული ართრიტის დროს. ამიტომ, 1988 წელს ამერიკის სურსათისა და წამლის სააგენტომ მეტოტრექსატი რევმატოიდული ართრიტის სამართავ მედიკამენტად დაამტკიცა და 1990-იანი წლებისთვის იგი პირველი რიგის სამკურნალო პრეპარატი გახდა.
1990-იან წლებში ბიოლოგიური დმარმ-ის განვითარების შედეგად დაავადების მკურნალობის უფრო მეტი შესაძლებლობა გაჩნდა. ჩვეულებრივად სინთეზირებული დმარმ-ისგან განსხვავებით, ბიოლოგიური და მიზანმიმართულად სინთეზირებული დმარმ-ები ანთებითი პროცესის სპეციფიკური სამიზნეების მოდულირებისთვის შეიქმნა. ეს აგენტები მოიცავენ მონოკლონურ ანტისხეულებს და გენური ინჟინერიით შეცვლილ ცილებს, რომლებიც მიმართულნი არიან ციტოკინების ან უჯრედის ზედაპირზე არსებული მოლეკულების წინააღმდეგ. თავდაპირველი აგენტები აინჰიბირებდნენ (თრგუნავდნენ) TNF-α-ს ბიოლოგიურ აქტივობას - ციტოკინის, რომელიც, როგორც ვიცით, რევმატოიდული ართრიტის დროს ანთებითი პასუხის შენარჩუნებაში მონაწილეობს, რასაც მივყავართ სინოვიალურ პროლიფერაციამდე და ძვლის დაშლამდე. TNF-ის პირველი ინჰიბიტორების (etanercept, infliximab, adalimumab და სხვ.) გამოჩენის შემდეგ, კლინიკური გამოყენებისთვის დაამტკიცეს ბიოლოგიური დმარმ-ები (rituximab, tocilizumab და სხვ.), რომლებიც ზეგავლენას ახდენენ იმუნური პასუხის სხვა ცნობილ კომპონენტებზე, რომლებიც, თავის მხრივ, ჩართულნი არიან რევმატოიდული ართრიტის პათოგენეზში. ჩვეულებრივ, ბიოლოგიური დმარმ-ები ინიშნება მეტოტრექსატთან ერთად. თუმცა, პაციენტთა მესამედზე მეტს აღენიშნება მეტოტრექსატის აუტანლობა, ასე რომ, კლინიკურ პრაქტიკაში პაციენტების დაახლოებით 30%-ს უტარდება ბიოლოგიური დმარმ-ებით მონოთერაპია. დმარმ-ების გამოყენებაზე საუბრისას, უნდა აღინიშნოს, რომ ეს მედიკამენტები არ მოქმედებენ მხოლოდ რევმატოიდულ ართრიტზე, მათი გამოყენება, ასევე შესაძლებელია სხვა ავტოიმუნური დაავადებების სამკურნალოდ, როგორიცაა ფსორიაზი, სისტემური წითელი მგლურა, შოგრენის სინდრომი, კრონის დაავადება და ზოგიერთი ტიპის კიბო.
ეს ყოველივე ბადებს რამდენიმე კითხვას: რამდენად გავრცელებულია დმარმ-ების გამოყენება საერთო პოპულაციაში და პაროდონტულ პაციენტებში? დიდი გერმანული სამედიცინო სადაზღვევო ბაზის საფუძველზე ჩატარებული ეპიდემიოლოგიური კვლევით დადგინდა, რომ 2004 და 2011 წლებში დმარმ-ების გამოყენება გაიზარდა. ჩვეულებრივად სინთეზირებული დმარმ-ების გამოყენება 2004 წლიდან 2011 წლამდე გაიზარდა 6.530/00-დან 8.930/00-მდე, მაშინ როცა ბიოლოგიური დმარმ-ების გამოყენება გაოთხმაგდა - 0.350/00-დან 1.540/00-მდე, 50-დან 79 წლამდე ასაკის ქალებში არსებითად უფრო მაღალი გავრცელებით. მეტოტრექსატი იყო ყველაზე ხშირად გამოწერილი ჩვეულებრივად სინთეზირებული დმარმ-ი, მას მოჰყვებოდა აზათიოპრინი და სულფსალაზინი. შესაბამისად, ბიოლოგიური დმარმ-ებიდან ყველაზე ხშირად გამოწერილი იყო ადალიმუმაბი, რომელსაც მოჰყვებოდა ეტანერცეპტი და რიტუქსიმაბი.
პაროდონტიტსა და რევმატოიდულ ართრიტს ბევრი მსგავსება აქვს პათოფიზიოლოგიური და კლინიკური მიმდინარეობის თვალსაზრისით, რევმატოიდულ ართრიტისა და პაროდონტიტის საერთო პროანთებითი და ქსოვილის დამაზიანებელი კავშირების გამო წამოიჭრა პაროდონტის ანთებაზე დმარმ-ის გავლენის საკითხი. რადგან აქამდე არცერთ კვლევას არ შეუფასებია დმარმ-ის გამოყენება პაროდონტიტიან პაციენტებში, ამ საკითხის გამოკვლევისთვის უნდა გავარკვიოთ თუ რა სიხშირით ესაჭიროებათ რევმატოიდული ართრიტით დაავადებულ პაციენტებს პაროდონტოლოგიური მკურნალობა, იმ ვარაუდით, რომ ასეთ პაციენტებს შესაძლოა ჩატარებული ჰქონდეთ მკურნალობა დმარმ-ით. ორ ათწლეულზე მეტი ხნის წინ, ქვინსლენდის უნივერსიტეტის სტომატოლოგიის სკოლის მკვლევართა ჯგუფმა ავსტრალიაში ჩაატარა კვლევა, რომ გამოერკვიათ დაავადების გავრცელება. მკვლევრებმა გააანალიზეს 1412 ინდივიდის მიერ თვითწარმოებული ჯანმრთელობის კითხვარი და იმ პაციენტების სტომატოლოგიური ჩანაწერები, რომლებიც გადამისამართებული იყვნენ პაროდონტოლოგიურ მკურალობაზე (საკვლევი ჯგუფი) ან სტუმრობდნენ კლინიკას ზოგადი სტომატოლოგიური მკურნალობის ჩასატარებლად (არაპაროდონტული მკურნალობისთვის, სატესტო ჯგუფი). მათ დაადგინეს, რომ პაროდონტიტის მქონე ყოველი 100 პაციენტიდან ოთხს ჰქონდა რევმატოიდული ართრიტი (3.95%) და ეს ციფრი მნიშვნელოვნად აღემატებოდა სატეტსო ჯგუფის მაჩვენებელს (0.66%). ამ შედეგებით ირკვევა, რომ დმარმ-ის მომხმარებელი პაციენტები არც თუ იშვიათად საჭიროებენ პაროდონტოლოგიურ დახმარებას. კვლევაში აღწერილია, რომ რევმატოიდული ართრიტის მქონე პაციენტებში ძვლის დანაკარგი (62.5%) უფრო მეტია, ვიდრე ამ დაავადების არმქონე პაციენტებში (43.8%), რაც იმაზე მიუთითებს, რომ რევმატოიდული ართრიტის მქონე პაციენტებს სჭირდებათ ჩვენი დახმარება, და მათი მკურნალობა შესაძლოა უფრო რთული იყოს პაროდონტიტის უფრო მძიმე ფორმის გამო.
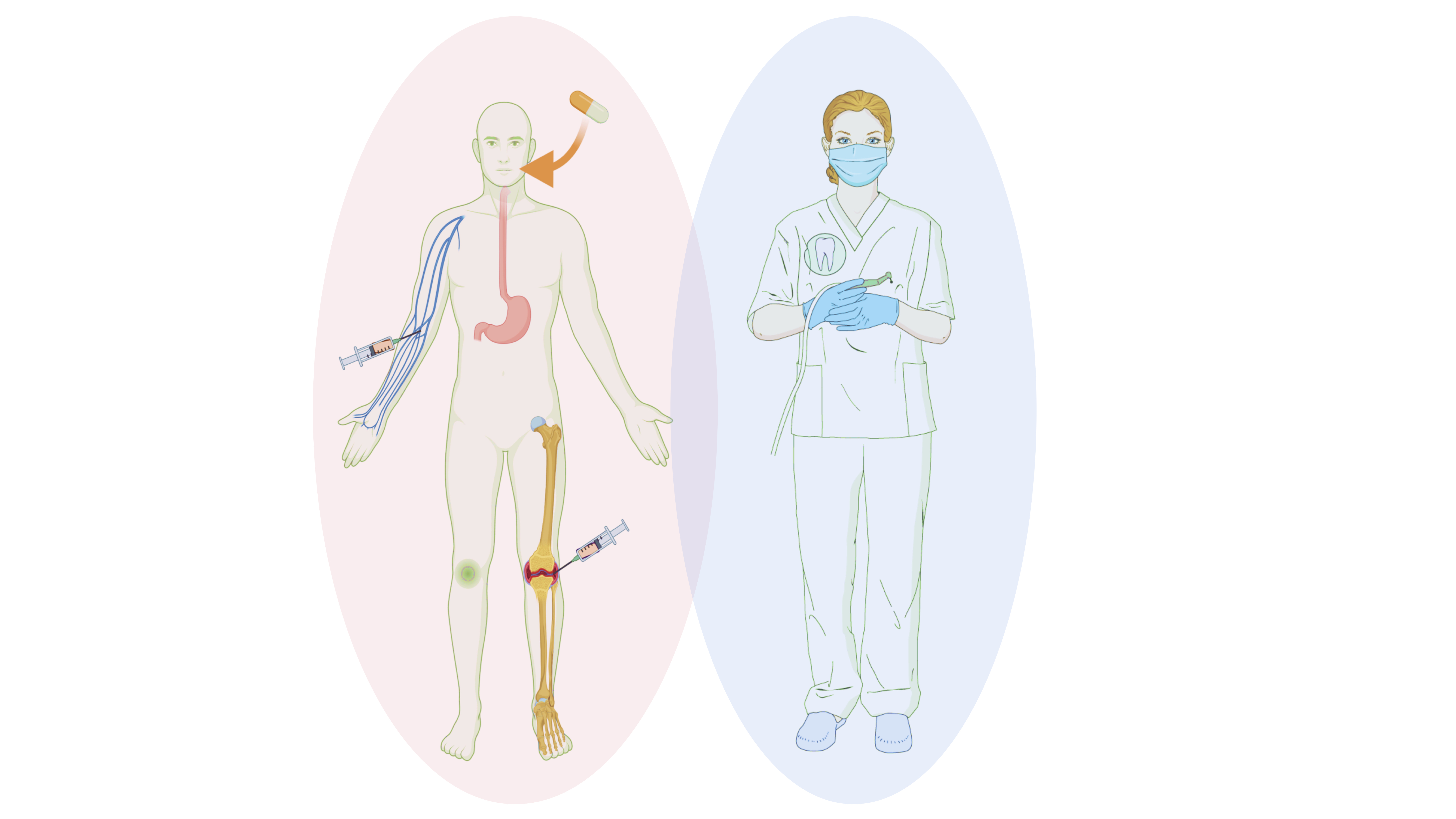
პაროდონტიტზე სინთეზირებული და ბიოლოგიური იმუნომოდულატორების გავლენის შესახებ დღემდე არსებული მტკიცებულებების უმეტესობა მცირე მასშტაბიანი ჯვარედინ-სექციური კლინიკური კვლევებია, რომლებიც პაროდონტულ სტატუსს აფასებს იმ პაციენტებში, ვისაც რევმატოიდული ართრიტის საწინააღმდეგო მკურნალობა უტარდება. ზოგიერთი კვლევის თანახმად, ჩვეულებრივად სინთეზირებული დმარმ-ების კომბინაცია (მეტოტრექსატი ლეფლუნომიდთან) უკავშირდება კლინიკური მიმაგრების უფრო მეტად დაკარგვას რევმატოიდული ართრიტის მქონე პაციენტებში; მაშინ როცა სხვა კვლევებით, რევმატოიდული ართრიტის მქონე პაციენტებში, რომელთაც მცირედ აქვთ გამოხატული პაროდონტული ანთება, არ ფიქსირდება პაროდონტული სტატუსის მნიშვნელოვანი განსხვავება იმ პაციენტებს შორის, რომლებიც იღებდნენ დმარმ-ს, მათგან რომლებიც არ იღებდნენ მსგავსს მედიკამენტებს და არ ჩასტარებიათ დამატებითი პაროდონტული მკურნალობა. ამის საპირისპიროდ, Jung-ისა და კოლეგების მიერ ჩატარებული უკანასკნელი კვლევით, რომელიც იძიებდა არაქირურგიულ პაროდონტულ მკურნალობაზე დამატებით ჩვეულებრივად სინთეზირებული დმარმ-ის გამოყენების გავლენას, როგორიცაა მეტოტრექსატი, ჰიდროქსიქლოროქინი და სულფასალაზინი, დადგინდა დამატებითი სარგებელი დმარმ-ის მომხმარებელთა ჯგუფში.
ბიოლოგიური დმარმ-ების შემთხვევაში, არსებული მონაცემები გარკვეულწილად შეუსაბამოა. მტკიცებულებათა მცირე ნაწილი გვიჩვენებს TNF-α-ს ინჰიბიტორების მნიშვნელოვან სარგებელს პაროდონტის კლინიკურ პარამეტრებზე, როცა რევმატოიდული ართრიტის მქონე პაციენტებში მათი მიღება ხდებოდა დამოუკიდებლად ან პაროდონტულ მკურნალობასთან კომბინაციაში, მაშინ, როდესაც სხვა კვლევებით აღწერილია ღრძილების ანთების გამწვავება BOP-ის გაზრდით. ახლახან გავრცელებული ინფორმაციით, TNF-ის საწინააღმდეგო მკურნალობის ხანგრძლივობას შესაძლოა გავლენა ჰქონდეს პაროდონტის კლინიკურ პარამეტრებზე, რადგან აღწერილია დამატებითი კლინიკური სარგებლის ტენდენცია, როცა ეს მედიკამენტები გამოყენებულ იქნა 6 კვირიდან 6 თვის განმავლობაში. ამის საპირისპიროდ, 6 თვეზე მეტი ხნის განმავლობაში მისი მიღება უკავშირდება ღრძილის ინდექსისა და BOP მომატებულ მაჩვენებელს. ეს შესაძლოა განპირობებული იყოს შემცირებული პასუხით ან პასუხის მეორადი დაკარგვით, რაც შეიძლება უკავშირდებოდეს წამლის საწინააღმდეგოდ წარმოქმნილ ანტისხეულებს, რაც ხშირად გვხვდება ბიოლოგიური დმარმ-ით მკურნალობის დროს. თუმცა, სხვა ბიოლოგიური დმარმ-ებით მკურნალობა, როგორიცაა ტოცილიზუმაბი (ინტერლეიკინ-6 რეცეპტორის ბლოკატორი), დამატებით პაროდონტული მკურნალობის და/ან პირის ღრუს ჰიგიენის სწავლების გარეშე, იძლევა პაროდონტული ჯიბის სიღრმის და კლინიკური მიმაგრების 6 თვის შემდეგ მცირე გაუმჯობესებას. ამასთანავე, ტოცილიზუმაბის 6 თვიანი გამოყენების შემდეგ შემცირდა ზონდირებით სისხლმდენი უბნების, ≥4მმ პაროდონტული ჯიბისა და ≥4მმ კლინიკური მიმაგრების დარღვევის მქონე უბნების პროცენტული რაოდენობა. ასევე პაციენტები, რომლებიც იღებდნენ რიტუქსიმაბს (B-უჯრედების ბლოკატორი) 6 თვის შემდეგ აღენიშნებოდათ ნაკლებად მძიმე პაროდონტიტი.
-მაბების გარდა, -ნიბები (ბარიციტინიბი, ტოფაციტინიბი და სხვ.) მოგვიანებით შეუერთდნენ დმარმ-ების ოჯახს. საუბარია იანუს კინაზას (JAK) ინჰიბიტორებზე - ორალური მედიკამენტების ახალ კლასზე, რომელიც დამტკიცდა რევმატოიდული ართრიტის სამკურნალოდ. ბარიციტინიბით 24 კვირიანი მკურნალობის შემდეგ, დამატებითი პაროდონტული მკურნალობის და/ან პირის ღრუს ჰიგიენის სწავლების გარეშე, მნიშვნელოვნად შემცირდა პაროდონტული ჯიბის სიღრმე, ≥4მმ პაროდონტული ჯიბის მქონე უბნების პროცენტული რაოდენობა და ზონდირებით სისხლმდენი უბნები, რაც მიუთითებს კლინიკურ სარგებელზე.
ყველა აღნიშნული მონაცემი ეფუძნება პაციენტების შეზღუდულ რაოდენობას, რომლებიც თავდაპირველად შეარჩიეს რევმატოიდული ართრიტის დიაგნოზის საფუძველზე და შემდეგ მათი მწვავე პაროდონტული სტატუსიდან გამომდინარე. შედეგად, მოცემული კვლევების პოპულაცია შესაძლოა იყოს ჰეტეროგენული პაროდონტის დაავადების სიმძიმის თვალსაზრისით და გაართულოს შესაბამისი დასკვნების გამოტანა. საბოლოოდ, უნდა გვახსოვდეს, რომ არცერთი ზემოთ ჩამოთვლილი მედიკამენტი არ არის საკმარისად „ჭკვიანი“, რომ დაავადების პათოგენეზში ჩართული ფაქტორი/ციტოკინი განასხვაოს გარეგანი აგენტების საწინააღმდეგოდ მიმართულ იმუნურ დაცვაში მონაწილე ფაქტორებისგან/ციტოკინისგან; ამგვარად იგი შესაძლოა იყოს ბევრი მნიშვნელოვანი გვერდითი მოვლენის ამოსავალი წერტილი, მათ შორის, ინფექციების მაღალი რისკის, განსაკუთრებით ქირურგიული ოპერაციების შემდეგ, როგორიცაა იმპლანტაცია. სამედიცინო მეცნიერებებში, სწორედ ღირებულება/სარგებლის თანაფარდობა წყვეტს „მეგობართან“ გვაქვს საქმე, თუ „მტერთან“ და ეს უნდა განისაზღვროს კლინიკური თვალსაზრისით სიცოცხლისთვის ყველაზე საშიში მდგომარეობებისთვის პრიორიტეტის მინიჭებით. მიუხედავად ამისა, ყველა ზემოთ ჩამოთვლილი კვლევა შეიძლება გამოდგეს იმის მაჩვენებლად, თუ რას უნდა ველოდოთ ჩვენ - პაროდონტოლოგები, კლინიკური სტატუსის თვალსაზრისით, როცა პაციენტები, რომლებიც იღებენ -მაბებსა და -ნიბებს და აბიჯებენ კლინიკის ზღურბლს. როგორც ძველი ათენის სახელგანთქმულმა კომედიოგრაფმა არისტოფანემ აღნიშნა თავის კომედიაში „ფრინველები“: „ადამიანმა შეიძლება სიბრძნე მტრისგანაც კი შეიმეცნოს“.
გამოყენებული და რეკომენდებული ლიტერატურა:
Atzeni, F., & Sarzi-Puttini, P. (2019). The therapeutic journey of biologic agents: There will be an end?. Pharmacological Research, 147, 104340. https://doi.org/10.1016/j.phrs.2019.104340
Ancuța, C., Pomîrleanu, C., Mihailov, C., Chirieac, R., Ancuța, E., Iordache, C., Bran, C., & Țănculescu, O. (2020). Efficacy of baricitinib on periodontal inflammation in patients with rheumatoid arthritis. Joint Bone Spine, 87(3), 235–239. https://doi.org/10.1016/j.jbspin.2019.12.003
Äyräväinen, L., Leirisalo-Repo, M., Kuuliala, A., Ahola, K., Koivuniemi, R., Meurman, J. H., & Heikkinen, A. M. (2017). Periodontitis in early and chronic rheumatoid arthritis: a prospective follow-up study in Finnish population. BMJ Open, 7(1), e011916. https://doi.org/10.1136/bmjopen-2016-011916
Balta, M. G., Papathanasiou, E., Blix, I. J., & Van Dyke, T. E. (2021). Host Modulation and Treatment of Periodontal Disease. Journal of Dental Research, 100(8), 798–809. https://doi.org/10.1177/0022034521995157
Mercado, F., Marshall, R. I., Klestov, A. C., & Bartold, P. M. (2000). Is there a relationship between rheumatoid arthritis and periodontal disease?. Journal of Clinical Periodontology, 27(4), 267–272. https://doi.org/10.1034/j.1600-051x.2000.027004267.x
Benjamin O, Bansal P, Goyal A, et al. Disease Modifying Anti-Rheumatic Drugs (DMARD) [Updated 2021 Jul 6]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan. Available from: https://www.ncbi.nlm.nih.gov/books/NBK507863/
Cillo, J. E., Jr, & Barbosa, N. (2019). Adalimumab-Related Dental Implant Infection. Journal of oral and maxillofacial surgery : official journal of the American Association of Oral and Maxillofacial Surgeons, 77(6), 1165–1169. https://doi.org/10.1016/j.joms.2019.01.033
Fassmer, A. M., Garbe, E., & Schmedt, N. (2016). Frequency and trends of disease-modifying antirheumatic drug (DMARD) use in Germany. Pharmacology Research & Perspectives, 4(5), e00254. https://doi.org/10.1002/prp2.254
Jung, G. U., Han, J. Y., Hwang, K. G., Park, C. J., Stathopoulou, P. G., & Fiorellini, J. P. (2018). Effects of Conventional Synthetic Disease-Modifying Antirheumatic Drugs on Response to Periodontal Treatment in Patients with Rheumatoid Arthritis. BioMed Research International, 2018, 1465402. https://doi.org/10.1155/2018/1465402
Pers, J. O., Saraux, A., Pierre, R., & Youinou, P. (2008). Anti-TNF-alpha immunotherapy is associated with increased gingival inflammation without clinical attachment loss in subjects with rheumatoid arthritis. Journal of Periodontology, 79(9), 1645–1651. https://doi.org/10.1902/jop.2008.070616
Zamri, F., & de Vries, T. J. (2020). Use of TNF Inhibitors in Rheumatoid Arthritis and Implications for the Periodontal Status: For the Benefit of Both?. Frontiers in Iimmunology, 11, 591365. https://doi.org/10.3389/fimmu.2020.591365
Ziebolz, D., Rupprecht, A., Schmickler, J., Bothmann, L., Krämer, J., Patschan, D., Müller, G. A., Mausberg, R. F., Schmidt, J., Schmalz, G., & Patschan, S. (2018). Association of different immunosuppressive medications with periodontal condition in patients with rheumatoid arthritis: Results from a cross-sectional study. Journal of Periodontology, 89(11), 1310–1317. https://doi.org/10.1002/JPER.17-0616
